第二章 习题
1.是非题(对的在括号里填“+”号,错的填“–”号)
(1)由于电子运动具有波动性,因此无法准确预言在某一时刻电子所处的位置。 ( )
(2)当n等于2时,l只能等于1。 ( )
(3)多电子原子轨道的能级取决于n,因此,只要知道了n值,就能知道轨道能级的高低次序。 ( )
(4)基态氢原子的电子在1s轨道上运动,即在一定半径的球体内运动;当电子受激发跃迁到2p轨道后便在“
(5)杂化轨道仍是原子轨道 ( )
(6)H2S晶体中,分子间共存在两种力,即诱导力和取向力。 ( )
(7)稀有气体晶体中,格点上的微粒是原子,说明稀有气体晶体是原子晶体。
(8)氯化氢溶于水后生成H+(aq)和Cl-(aq),说明氯化氢晶体是离子晶体。
(9)过渡型晶体原子间结合力复杂,因此无法准确知道原子间存在哪些力。
2.填空题
(1)25号元素的核外电子分布式为 ,外层电子构型为 ,该元素的最高氧化数是 ,+2价离子的外层电子分布式为 ;该元素处在周期表第 周期, 族, 区。
(2)有五种元素,其外层电子构型分别为4s2、3s23p5、3d54s1、4d105s1、6s26p2,这五种元素分别是 、 、 、 、 ,其最高氧化数分别是 、 、 、 、 。
(3)填充下表
|
原子序数 |
原子外层电子构型 |
未成对电子数 |
周期 |
族 |
区 |
|
11 |
|
|
|
|
|
|
14 |
|
|
|
|
|
|
26 |
|
|
|
|
|
|
80 |
|
|
|
|
|
(4)填充下表
|
化学式 |
分子空间构型 |
中心原子杂化类型 |
是否极性分子 |
|
BeCl2 |
|
|
|
|
CCl4 |
|
|
|
|
H2S |
|
|
|
|
PCl3 |
|
|
|
|
BBr3 |
|
|
|
3.解释下列名词
电子云、原子半径、等性杂性、极性分子、格点、金属键
4.比较说明微观粒子运动与宏观的质点运动有何不同。
5.下列各组量子数是否合理?不合理的请改正之。
n l m
(1) 2 2 0
(2) 3 1 +1
(3) 1 0 –1
(4) 2 3 –1
6.写出下列各离子的外层电子分布式,并指出它们各属哪种电子构型。
Mg2+、Cr3+、Br-、Cd2+、Ni2+、Ti4+
7.试根据元素电负性大小,把下列元素按金属性递减的顺序排列。
Mg、N、Ca、C、B、O、F、Al、Ga、Na
8.为什么共价键具有方向性和饱和性?
9.下列分子中既有![]() 键,又有
键,又有![]() 键的有哪些?
键的有哪些?
甲烷(CH4) 乙烯(CH2CH2)
乙酸(CH3COOH) 甲醚(CH3OCH3)
氮(N2) 联氨(N2H4)
10.判断乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的熔、沸点哪个高并解释之。
11.下列化合物中,既有离子键,又有共价键的有哪些?
KOH Na2S CO2
Na2CO3 MgO CHCl3
12.下列各晶体熔化时只需克服色散力的有哪些?
SiH4 CH3COOH CS2
H2S SiO2 Ca(OH)2
13.判断下列物质哪些易溶于水?哪些难溶于水?
![]()
![]() O
O
O
O
![]() 甲酸(HC ) 丙酮(CH3CCH3)
甲酸(HC ) 丙酮(CH3CCH3)
OH
氯仿(CHCl3) 碘单质(I2)
碘化钾(KI) 碳化硅(SiC)
14.判断下列各组中两种物质的熔点高低,并解释之。
(1)KBr和BaO (2)NaCl和CsCl
(3)H2O和H2S (4)SiCl4和SiC
(5)正丁烷(C4H10)和正辛烷(C8H18)
15.指出下列各种物质的熔点高低顺序并解释之。
NaCl HCl HI MgO KBr I2
16.解释下列金属的熔点高低顺序并解释之。
K<Ca<Sc<Ti<V
17.电负性的涵义是什么?电负性与金属性、非金属性有何联系?
18.四氯化碳的熔点、沸点低是否说明CCl4分子不稳定?为什么?
19.为什么干冰(CO2晶体)和石英(SiO2晶体)的物理性质差别很大?
20.试说明分子间形成氢键的条件并判断下列物质中含氢键的有哪些。
H2SO4、HCl、HNO3、CH3COOH、CH3OCH3、NH3
第三章 习题
1是非题(对的在括号中填“+”号,错的填“-”号)
(1)在恒温恒压下,下面两个反应方程式相应的平衡常数表达式不同。 ( )
2Mg(s)+O2(g)=2MgO(s)
Mg(s)+![]() O2(g)=MgO(s)
O2(g)=MgO(s)
(2)![]() 反应C(s)+H2O(g)
CO(g)+H2(g)为吸热反应
反应C(s)+H2O(g)
CO(g)+H2(g)为吸热反应
①由于反应方程式两边物质的化学计量数的总和相等,所以改变容器的体积对平衡无影响。
( )
②上述反应达平衡后,降低温度,正反应速率减小,逆反应速率增大,所以反应向左进行。
( )
(3)反应2A(g)+B(g)=2C(g)为放热反应
①由于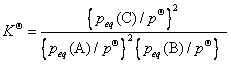 随着反应的进行,p(C)不断增大,p(A)和p(B)不断减小,平衡常数Kθ不断增大。
( )
随着反应的进行,p(C)不断增大,p(A)和p(B)不断减小,平衡常数Kθ不断增大。
( )
②减小容器体积,正反应速率增大,逆反应速率减小,故平衡向右移动。 ( )
③加入催化剂,正反应速率增大,平衡向右移动。 ( )
2.选择题(将正确的标号填入空格中)
(1)将压力均为100kPa的1LN2和
(A)100 (B)200 (C)300 (D)400
(2)某温度下,容器中含有2.0molO2(g)、3.0molN2和1.0molAr(g),若混合气体总压为akPa,则O2(g)的分压为_____kPa.
(A) A/3 (B)a/6 (C)a (D)a/2
(3)反应H2(g)+Br2(g)=2HBr的标准平衡常数为![]() =4×10-2 ,则反应
1/2H2(g)+1/2Br2(g)=HBr的平衡常数为_____
=4×10-2 ,则反应
1/2H2(g)+1/2Br2(g)=HBr的平衡常数为_____
(A)![]() (B)
(B)![]() (C)
(C) ![]() (D)
(D)![]()
(4)反应2X+2Y=3Z的反应级数为
(A)4 (B)3 (C)2 (D)无法判断
(5) 增大反应物的浓度,使反应速率加快的主要原因是
(A)活化能降低 (B)系统的混乱度增加 (C)活化分子分数增加(D)单位体积内活化分子的总数增加
(6)升高温度,化学反应速率加快的主要原因是
(A)系统的混乱度增加 (B)活化分子分数增加 (C)分子运动加快 (D)活化能增加
1.填空题
(1) 在恒温下,将
(2) 某温度下反应2X(g)=Y(g)的![]() =7.89,若将气体X与Y混合后,X(g)的分压为20.265kPa,Y(g)的分压为50.6625kPa,此时的反应商为_____,反应将向____进行。
=7.89,若将气体X与Y混合后,X(g)的分压为20.265kPa,Y(g)的分压为50.6625kPa,此时的反应商为_____,反应将向____进行。
(3) 对于____反应,其反应级数一定等于反应的化学计量数______,速率常数的单位由_____决定,若速率常数的单位是mol-2·L+2·s-1时,该反应是_______级反应。
(4) 在化学反应中,加入催化剂使反应速率加快的主要原因是_____,活化能_____,速率常数______。
(5) 对于反应C(s)+CO2(g)=2CO(g),![]() 请填充下表:
请填充下表:
|
|
k正 |
k逆 |
v正 |
v逆 |
|
平衡移动方向 |
|
升高温度 |
|
|
|
|
|
|
|
加入催化剂 |
|
|
|
|
|
|
|
减小容器的体积 |
|
|
|
|
|
|
2.合成氨反应在某温度下于密闭容器中进行,若N2和H2的起始压力分别为100kPa和300kPa,达到平衡时的N2的转化率为10%,问此时的平衡常数为多少?
3.在一定温度下,反应2NO(g)+Cl2(g)=2NOCl(g)符合质量作用定律。
(1) 写出反应的反应速率方程。
(2) 该反应的反应级数为多少?
(3) 其他条件不变,若将容器的体积增加到原来的2倍,反应速率将如何变化?
(4) 若容器的体积不变,而将NO的浓度增加为原来的3倍,反应速率将如何变化?
4.在高温时焦碳与CO2的反应为C(s)+CO2(g)=2CO(g),实验测得该反应的活化能为167.36kJ·mol-1,计算温度由900K升高到1000K时,反应速率之比。
5.活化分子和活化能的定义是什么?使用活化分子和活化能的概念解释浓度、温度和催化剂对反应速率的影响。
第四章 习题
1.是非题(对的在括号中填“+”号,错的填“-”号)
(1)已知反应Mg(s)+![]() O2 (g)=MgO(s)的Δr
O2 (g)=MgO(s)的Δr![]() (298.15K)=-601.83
(298.15K)=-601.83![]() ,因此,燃烧1molMg(g) 吸收601.83kJ的热量。 ( )
,因此,燃烧1molMg(g) 吸收601.83kJ的热量。 ( )
(2)在恒温恒压下,下面两个反应方程式的焓变相同。
Mg(s)+![]() O2 (g)=MgO(s)
O2 (g)=MgO(s)
2Mg(s)+ O2 (g)=2MgO(s) ( )
(3)指定稳定态单质的Δf![]() (298.15K) 、Δf
(298.15K) 、Δf![]() (298.15K)和
(298.15K)和![]() (298.15K)均为零。
( )
(298.15K)均为零。
( )
(4)在恒温恒压下,若反应产物的分子总数比反应物分子总数多,该反应的ΔrSm一定为正值。 ( )
(5)在常温常压下,将H2和O2长期混合无明显反应,表明该反应的吉布斯函数变为正值。 ( )
(6)某反应的ΔrHm和ΔrSm皆为负值,当温度升高时,ΔrGm将增大。 ( )
(7)可逆反应平衡时,必有Δr![]() (TK)=0。
( )
(TK)=0。
( )
(8)吸热反应也可能是自发反应。 ( )
(9)ΔrSm为正值的反应均是自发反应。 ( )
(10)某反应的ΔrG m > 0,选取适宜的催化剂可使反应自发进行。 ( )
2.选择题(将正确答案的标号填入空格内)
(1)![]() (NH3,g,298.15K)等于
(NH3,g,298.15K)等于
![]() 。
。
(A) —2.71/17 (B)2.71/17 (C) —2.71×17 (D)2.71×17
(2)已知反应Zn(s)+![]() O2(g)=ZnO(s)的Δr
O2(g)=ZnO(s)的Δr![]() (298.15K)= —348.3
(298.15K)= —348.3![]() ,Hg(l)+
,Hg(l)+![]() O2 (g)=HgO(s)的Δr
O2 (g)=HgO(s)的Δr![]() (298.15K)=—90.83
(298.15K)=—90.83![]() ,则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的Δr
,则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的Δr![]() (298.15K)为
(298.15K)为
![]() 。
。
(A) —439.11 (B)439.11 (C) —257.47 (D)257.47
(3)下列反应中,放出热量最多的反应是 。
(A) CH4 (l)+2O2 (g)=CO2 (g)+2H2O(g)
(B) CH4 (g)+2O2 (g)=CO2 (g)+2H2O(g)
(C) CH4 (g)+2O2 (g)=CO2 (g)+2H2O(l)
(D)
CH4 (g)+ ![]() O2 (g)=CO (g)+2H2O(l)
O2 (g)=CO (g)+2H2O(l)
(4)反应CaO(s)+ H2O(l)=
Ca(OH) 2 (l)在
(A)
Δr![]() >0,Δr
>0,Δr![]() <0
(B) Δ
<0
(B) Δ![]() >0,Δr
>0,Δr![]() >0
>0
(C) Δr![]() <0,Δr
<0,Δr![]() <0
(D) Δr
<0
(D) Δr![]() <0,Δr
<0,Δr![]() >0
>0
(5)下列反应中,熵值增加最多的反应是 。
(A) 4Al(s)+3O2 (g)=2Al2O3 (s) (B) Ni(CO) 4 (s) =Ni(s) +4CO (g)
(C)S(s)+H2 (g)=H2S (g) (D)MgCO3 (s) =MgO (s) +CO2 (g)
(6)某反应的Δr![]() (298.15K)= 45
(298.15K)= 45![]() ,Δr
,Δr![]() (298.15K)= 90
(298.15K)= 90![]() ,据估算该反应处于平衡时的温度为
K。
,据估算该反应处于平衡时的温度为
K。
(A) 273 (B) 298 (C) 546 (D)596
(7)化学反应在恒温恒压下均能自发进行的条件是 。
(A)Δr![]() >0,Δr
>0,Δr![]() <0
(B)
<0
(B) ![]() >0,Δr
>0,Δr![]() >0
>0
(C) Δr![]() <0,Δ
<0,Δ![]() <0
(D)
<0
(D) ![]() <0,Δr
<0,Δr![]() >0
>0
(8)下列热力学函数为零的是 。
(A) ![]() (O2,g,298.15K) (B) Δf
(O2,g,298.15K) (B) Δf![]() (I2,s,298.15K)
(I2,s,298.15K)
(C) Δf![]() (Na+,aq,298.15K) (D) Δf
(Na+,aq,298.15K) (D) Δf![]() (金刚石,298.15K)
(金刚石,298.15K)
(9)反应H2
(g) +Cl2 (g)=HCl(g)的Δf![]() (298.15K)= —95.299
(298.15K)= —95.299![]() ,则
,则![]() 为
。
为
。
(A) 5 ×1038 (B) 2 ×1033 (C)2×1018 (D) 5×1016
(10)恒温恒压下,反应自发性的热力学判据是 。
(A) ΔH<0 (B) ΔS<0 (C) ΔG<0 (D) ΔU<0
3. 填空题
(1)如果系统经过一系列变化回到初始状态,则系统在变化过程中,ΔU等于 ,ΔH等于 ,热效应q 。
(2)ΔG 于零时,反应是自发的。根据ΔG=ΔH—TΔS得:当ΔS为正值时,放热反应 自发的,当ΔS为负值时,放热反应 自发。
(3)已知某反应在300 K和500 K时的Δr![]() 分别为—105.0
分别为—105.0 ![]() 和—125.0
和—125.0![]() ,则该反应的Δ
,则该反应的Δ![]() 为
,Δr
为
,Δr![]() 为
。
为
。
(4)已知反应N2
(g)+3H2 (g)=2NH3 (g) 的Δr![]() (298.15K)= —92.22
(298.15K)= —92.22 ![]() ,若升高温度,Δr
,若升高温度,Δr![]() 将 ,Δr
将 ,Δr![]() ,Δr
,Δr![]() 。
。
(5)比较同类物质的生成热数据,可以判断这些化合物的相对稳定性。例如,CaO(s)、HgO(s)的Δf![]() (298.15K)分别为—635.5
(298.15K)分别为—635.5 ![]() 和—58.16
和—58.16 ![]() ,所以, 比 稳定。
,所以, 比 稳定。
(6)Br2
(g) 、Br2
(l) 、 Br2
(aq) 、 Br-
(aq)中,Δf![]() (298.15K)为零的是 。
(298.15K)为零的是 。
(7)煤的主要组成是 ,汽油中代表性组分是 ,天然气中主要组分是 。
(8)因燃烧煤炭污染大气而造成酸雨的主要有害气体是 。
(9)原子核能有 和 两种能量来源。
4.葡萄糖C6H12O6被完全氧化的反应方程为 C6H12O6
(s)+6O2 (g)=6CO2 (g)+6H2O(l), Δr![]() (298.15K)= —2820
(298.15K)= —2820![]() 。当葡萄糖在人体内氧化时,上述反应热效应的约30%用作肌肉的活动能量。估计
。当葡萄糖在人体内氧化时,上述反应热效应的约30%用作肌肉的活动能量。估计
5.已知反应CaCO3 (s)=CaO(s)+CO2
(g)和C(s)+O2
(g)=CO2 (g),利用Δf![]() (298.15K)数据,计算
(298.15K)数据,计算
6.不查表,将下列物质按![]() (298.15K)值由大到小的顺序排列,并简要说明理由。
(298.15K)值由大到小的顺序排列,并简要说明理由。
Br2 (g) 、Br2 (l) 、Mg(s)、NH4Cl(s)
7.已知(1) 2Fe(s)+ ![]() O2 (g)=Fe2O3 (s), Δr
O2 (g)=Fe2O3 (s), Δr![]() (298.15K)= —742.2
(298.15K)= —742.2 ![]() ;(2) 4 Fe2O3 (s)+Fe(s)=3 Fe3O4 (s),Δr
;(2) 4 Fe2O3 (s)+Fe(s)=3 Fe3O4 (s),Δr![]() (298.15K)= —77.7
(298.15K)= —77.7 ![]() 。计算 Fe3O4 (s)在298.15 K时的标准生成吉布斯函数。
。计算 Fe3O4 (s)在298.15 K时的标准生成吉布斯函数。
8.计算下列反应的Δr![]() (298.15K)和Δr
(298.15K)和Δr![]() (298.15K)。
(298.15K)。
(1) 3Fe(s)+4H2O(l)= Fe3O4 (s)+4H2 (g)
(2) Zn(s)+2H+ (aq)=Zn2+ (aq)+ H2 (g)
(3) CaO(s)+H2O(l)=Ca2+ (aq)+2OH- (aq)
9.通过计算判断反应2NH3 (g) =N2 (g)+3H2 (g)
(1)在标准状态和298.15K时的自发性;
(2)使该反应在标准状态自发进行的最低温度是多少?
10.已知下列反应(1)Fe(s)+CO2 (g)= FeO
(s)+CO(g)的K![]() 和
和
(2)Fe(s)+H2O(g)=
FeO (s)+H2 (g) 的K![]()
在不同温度下的数值如下:
T/K 973 1073 1173 1273
K![]() 1.47
1.81
2.15
2.48
1.47
1.81
2.15
2.48
K![]() 2.38
2.00
1.67
1.49
2.38
2.00
1.67
1.49
试计算在上述各温度时反应CO2 (g)+ H2
(g)= CO(g)+ H2O(g)的![]() 值,并由计算结果说明该反应是放热还是吸热。
值,并由计算结果说明该反应是放热还是吸热。
10.已知反应![]() H2 (g)+
H2 (g)+![]() Cl2 (g)=HCl(g) 在298.15K时的
Cl2 (g)=HCl(g) 在298.15K时的![]() =4.9×1016,Δr
=4.9×1016,Δr![]() (298.15K)= —92.307kJ.mol-1,不查附录数据,估算在500K时的
(298.15K)= —92.307kJ.mol-1,不查附录数据,估算在500K时的![]() 值。
值。
11.近似计算反应CO2 (g)+ H2 (g)= CO(g)+ H2O(g)在973K时的Δr![]() (973K) 和Kq值。若系统中各组分气体的分压为p(CO2)= p(H2)=127kPa, p(CO)=
p(HO2)=76kPa。计算此时的ΔrG m(973K) 值并判断反应进行的方向。
(973K) 和Kq值。若系统中各组分气体的分压为p(CO2)= p(H2)=127kPa, p(CO)=
p(HO2)=76kPa。计算此时的ΔrG m(973K) 值并判断反应进行的方向。
12.汽车内燃机工作时温度可达
![]() N2 (g)+
N2 (g)+![]() O2 (g)=NO(g) 的Δr
O2 (g)=NO(g) 的Δr![]() 和
和![]() 值,并说明对大气有无污染。
值,并说明对大气有无污染。
13.煤炭燃烧时为什么首先要加热?该反应是吸热反应还是放热反应?
第五章 习题
1.是非题(对的在括号内填“+”,错的填“-”)
(1)两种一元弱酸溶液有同样的pH值,则这两种溶液的浓度相同。 ( )
(2)PbI2和CaCO3的溶度积近似为10-9,从而可知两者的饱溶液中Pb2+的浓度与Ca2+的浓度近似相等。 ( )
(3)MgCO3的溶度积为6.82×10-6,这意味着有MgCO3的溶液中,C(Mg2+)=C(CO32-) =6.82×10-6,而且C(Mg2+)·C(CO32-)=6.82×10-6。 ( )
2.选择题(将正确答案的标号填入括号内)
(1)往1dm30.10mol·dm-3HAc溶液中加入一些NaAc固体并使之溶解,会发生的情况是( )
(A)HAc的![]() 值增大 (B)HAc的
值增大 (B)HAc的![]() 值减小 (C)溶液的pH值增大(D)溶液的pH值减小
值减小 (C)溶液的pH值增大(D)溶液的pH值减小
(2)设氨水的浓度为C,若降其稀释1倍,则溶液中的OH-浓度为( )
(A)![]() (B)
(B)![]() (C)
(C)![]() (D)
(D)
3.填空题
(1) 下列物质H2SO4、HAc、HCN、H2CO3、NH3·H2O、 NaOH的浓度均为0.1mol·dm-3,按溶液的pH值由大到小顺序将它们排列:__________________________________________
(2) 根据酸碱质子理论,下列物质H2S、NH3、HS-、CO32-、HCO3-、Ac-、OH-、H2O中,属于酸的有_________,属于碱的有_________,属于两性的有______________。
(3) 用溶度积解释下列事实:
①CaCO3溶于稀HCl中
②MgOH溶于NH4Cl的溶液中
③AgCl沉淀溶于NH3·H2O中
4.在某温度下0.10mol·dm-3氢氰酸(HCN)的解离度为0.01%,求该温度下HCN的解离常 数。
5.
计算
6. 取50ml0.10mol·dm-3的一元弱酸的溶液,与20ml0.10mol·dm-3KOH溶液混合,将其稀释至100ml,测得此溶液的pH值为5.25。求此一元弱酸的解离常数。
7. 在烧杯中盛放着20ml0.10mol·dm-3的氨水溶液,逐渐加入0.10mol·dm-3的HCl溶液。试计算:
(1)当加入10mLHCl后,混合液的pH值。
(2)当加入30mlHCl后,混合液的pH值。
8. 现有125ml1.00mol·dm-3NaAc溶液,欲配制250ml pH值为5.0的缓冲溶液,需加入6.00mol·dm-3HAc溶液多少毫升?
9. 通过计算,说明下列条件下能否有沉淀生成?
(1)在10ml0.0015mol·dm-3的MnSO4溶液中加入5ml0.15mol·dm-3的氨水溶液;
(2)若在上述10ml0.0015mol·dm-3的MnSO4溶液中,先加入
10.某溶液中含有Pb2+和Ba2+,它们的浓度分别为0.10mol·L-1和0.010mol·L-1,逐渐加入K2CrO4溶液,问哪种离子先沉淀?两者有无可能分离?(![]() (PbCrO4)=2.8×10-13,
(PbCrO4)=2.8×10-13, ![]() (BaCrO4)=1.17×10-10).
(BaCrO4)=1.17×10-10).
11.为什么食盐和冰的混合物可以作冷冻剂?
12.什么是同离子效应?在HAc溶液中加入下列物质时,HAc的解离平衡将向何方移动?
(1)NaAc(s) (2)HCl(aq) (3)NaOH(s)
第七章 习题
1.是非题(对的在括号内填“+”号,错的填“-”号)
(1)原电池正极发生氧化反应,负极发生还原反应。
( )
(2)电极电势值越大,则电对中氧化态物质的氧化能力越强。
( )
(3)电极电势值越小,则电对中还原态物质的还原能力越弱。
( )
(4)电对中氧化态物质的氧化性越强,则还原态物质的还原性相应越弱。 ( )
(5)电池的标准电动势![]() >0,则电池反应一定能自发进行。
( )
>0,则电池反应一定能自发进行。
( )
(6)增大电对中氧化态物质的浓度,电极电势增大。
( )
(7)降低电对中还原态物质的浓度,电极电势减小。
(
)
(8)电动势(或电极电势)的值与反应式(或半反应式)的写法无关,而标准平衡常数![]() 及反应的标准摩尔吉布斯函数变Δr
及反应的标准摩尔吉布斯函数变Δr![]() 的值则与反应式的写法有关。 (
)
的值则与反应式的写法有关。 (
)
(9)钢铁在大气的中性或弱酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。 ( )
(10)电池反应2I–(aq)+2Fe3+(aq)=I2(s)+2Fe2+(aq)的电池符号为:
(-)Pt| I2 | I– (c1)‖Fe2+(c2)|Fe3+(c3)(+) ( )
(11)![]() 所以还原能力为Mg>Fe2+>Mn2+。
( )
所以还原能力为Mg>Fe2+>Mn2+。
( )
(12)因为![]() ,故Fe3+与Ag+能发生氧化还原反应。
( )
,故Fe3+与Ag+能发生氧化还原反应。
( )
(13)Co2++2e-=Co,![]() ,故
,故![]() 。( )
。( )
(14)在电池反应中,如果电池电动势值越大,则反应进行得越快。 ( )
2.选择题(将正确答案的标号填入空格内)
(1)在标准条件下,下列反应均向正方向进行:
![]()
![]() 它们中间最强的氧化剂和还原剂是
。
它们中间最强的氧化剂和还原剂是
。
(A)![]() B)
B)![]() (C)
(C)![]() (D)
(D)![]() (2)对于原电池(-)Zn|
Zn2+(c1)┊┊Cu2+(c2)|Cu(+) ,若向Zn2+溶液中加入少量Na2S溶液,或向Cu2+溶液中加入少量固体
(2)对于原电池(-)Zn|
Zn2+(c1)┊┊Cu2+(c2)|Cu(+) ,若向Zn2+溶液中加入少量Na2S溶液,或向Cu2+溶液中加入少量固体![]() ,则原电池的电动势
。
,则原电池的电动势
。
(A)减小 (B)增大 (C)不变 (D)无法判断
(3)已知![]() ,下列说法正确的是:
,下列说法正确的是:
(A) Br2只能氧化I2,不能氧化Cl2
(B) I-能还原Cl-和Br-
(C) Br-能还原Cl2,但不能还原I2
(D) Cl2可氧化Br-,但不能氧化I-
(4)由两个氢电极组成原电池,其中之一是标准氢电极,为了得到最大的电动势,另一电极所用溶液[设p(H2)=100kpa]为 。
(A)![]() (B)
(B)![]()
(C)![]() +
+![]() (D)
(D)![]()
(5)对于电池反应![]() ,当该原电池的电动势为零时,Cu2+浓度为
。
,当该原电池的电动势为零时,Cu2+浓度为
。
(A)![]() (B)
(B)![]()
(C)![]() (D)
(D)![]()
3. 填空题
(1)现有四种氧化剂K2Cr2O7、Cl2、FeCl3和KMnO4,当增大溶液的H+浓度时,氧化能力不变的有 ,氧化能力增强的有 。
(2)测得原电池(-)Zn| Zn2+(c1)┊┊Cu2+(c2)|Cu(+)的电动势为1.00V,这是由于 离子浓度比 离子浓度大。
(3)已知![]() ,若组成原电池,其电池符号是
,正极反应为
,负极反应为
,总反应为
。
,若组成原电池,其电池符号是
,正极反应为
,负极反应为
,总反应为
。
4.写出下列反应的氧化半反应和还原半反应(须配平)。
(1)![]()
(2)![]()
(3)![]()
5.将下列氧化还原反应设计成原电池,并用符号表示。
(1)![]()
(2)![]()
6.根据电对![]() 的标准电极电势判断,若将两电对组成原电池,哪一电对作正极?哪一电对作负极?写出电极反应和电池反应。
的标准电极电势判断,若将两电对组成原电池,哪一电对作正极?哪一电对作负极?写出电极反应和电池反应。
7.根据标准电极电势,确定下列各物质中哪些是氧化剂?哪些是还原剂?并排出其氧化能力和还原能力的大小顺序。
![]()
8.计算下列电池反应在298.15K的E或![]() ,Δr
,Δr![]() 或Δr
或Δr![]() 值,并指出反应能否自发进行。
值,并指出反应能否自发进行。
(1)![]()
(2)![]()
9.下列两反应的![]() 是否相等?
是否相等?
(1)![]()
(2)![]()
10.写出下列电池反应或电极反应的Nernst方程式,并计算其E或电极电势的值。
(1)已知![]() 。
。
![]()
(2)![]()
![]()
11.pH=5.0时,下面的反应能否自发进行(除H+外,其余物质均处于标准态)?通过计算加以分析。
![]()
12.由镍电极和标准氢电极组成原电池,其中镍电极为负极。当![]() 时,原电池的电动势为0.315V,计算镍电极的标准电极电势。
时,原电池的电动势为0.315V,计算镍电极的标准电极电势。
13.由两个氢电极H2(100kpa)∣H+(![]() )∣Pt和H2(100kpa)∣H+(xmol·dm-3)∣Pt组成原电池,测得该原电池的电动势为0.016V,若后一电极作为该原电池的正极,问组成该电极的溶液中的H+浓度x为多少?
)∣Pt和H2(100kpa)∣H+(xmol·dm-3)∣Pt组成原电池,测得该原电池的电动势为0.016V,若后一电极作为该原电池的正极,问组成该电极的溶液中的H+浓度x为多少?
14.判断下列反应在标准状态下进行的方向。
(1)![]()
(2)![]()
(3)![]()
(4)![]()
15.由标准氯电极和标准钴电极组成原电池,测得其电动势为1.64V,此时钴电极(![]() )为负极,已知
)为负极,已知![]() ,问:
,问:
(1)不查表,试计算钴电极的标准电极电势为多少?
(2)此电池反应的方向如何?
(3)当氯气压力增大或减小时,原电池的电动势将发生怎样的变化?
(4)当![]() 时,原电池的电动势为多少?
时,原电池的电动势为多少?
16.从标准电极电势分析下面反应进行的方向如何?
![]()
实验室根据什么原理,采取什么措施,利用上述反应制备氯气?
17.在298.15K时,下列哪个反应进行得更完全?
(1)![]()
(2)![]()
18.用标准电极电势解释:
(1) 将铁钉投入CuSO4溶液时,Fe被氧化为Fe2+而不是Fe3+;
(2) 铁与过量的氯气反应生成FeCl3而不是FeCl2。
(3) 铁和过量的盐酸反应生成Fe2+化合物,而铁和过量的硝酸反应生成Fe3+化合物。
19.判断下列各物质在标准状态下能否共存?为什么?
(1)Fe3+和Sn2+ (2)Fe2+和MnO4-(酸性介质)
(3)Cl-,Br-和I- (4)Fe2+和Sn4+
20.现有一铜-锌原电池:
(-)Zn∣ZnSO4(![]() )‖CuSO4(
)‖CuSO4(![]() )∣Cu(+)
)∣Cu(+)
(1) 改变下列条件对原电池电动势有何影响?
A. 增大CuSO4溶液的浓度;
B. ZnSO4溶液中加入过量的NaOH溶液;
C. 增加锌片的表面积;
D. 在CuSO4溶液中加入饱和H2S溶液。
(2) 当铜-锌原电池工作一段时间后,原电池的电动势是否发生改变?为什么?
21.为什么FeCl3溶液能腐蚀印刷电路的铜板?
22.镀层破裂后,为什么镀锌铁(白铁)比镀锡铁(马口铁)耐腐蚀?
23.今有一种含Cl-,Br-和I- 3种离子的酸性溶液,欲使I-被氧化成I2,而Cl-和Br-不被氧化,试问在常用的氧化剂Fe2(SO4)3和KMnO4中应选择哪一种?
24.钢铁的电化学腐蚀主要有几种?防止腐蚀有哪些方法?
25.分别写出钢铁在潮湿大气中和钢铁完全浸没在稀H2SO4中两极发生腐蚀的主要反应。
26.阴极保护法有哪两种方法?各依据什么原理?
第八章 习题
1. 是非题(对的在括号中填“+”,错的填“﹣”)
(1) 就金属单质的熔点来说,大致有这样的变化情况,周期系中部的ⅣΒ、ⅤΒ、ⅥΒ族金属的熔点较高,左右两边的熔点较低。 ( )
(2) 在金属活动顺序表中位置越前的金属越活泼,因而也一定越易腐蚀。 ( )
(3) 凡是标准电极电势小于零的金属都能从水中置换出氢气。 ( )
(4) 金属只有与非氧化性酸反应才能置换出氢气。 ( )
2. 选择题(将正确答案的标号填入空格内)
(1)用于合金钢的元素可以是 。
(A)锡和铋 (B)钾和钠
(C)钼和铬 (D)锶和钡
(2)钠在空气中燃烧的氧化物主要是 。
(A)正常氧化物 (B)过氧化物
(C)超氧化物 (D)臭氧化物
(3)下列物质具有金属光泽的是 。
(A)TiO2 (B)TiC (C)TiCl4 (D)Ti(NO3)4
3.填空题
(1)迄今为止,共发现 种元素,其中金属元素有 种,非金属有 种。
(2)金属单质中,熔点最高的是 ,最低的是 ;硬度最大的是 ;导电性最好的是 。
(3)耐高温金属是指熔点不低于 的金属,常见的耐高温有 ,
和 。
(4) 、 、 和 是两性金属。
(5)合金分为 、 、和 三种类型。
4.比较钙和锌:(1)原子的外层电子构型;(2)与氧的作用;(3)与酸的作用。
5.比较金刚石与钛:(1)原子的外层电子构型;(2)晶体类型;(3)元素的电负性;(4)熔点;(5)硬度;(6)常温时的氧化还原性。
6.分别写出K与氧气作用生成过氧化物,超氧化物的化学反应方程式。并写出两种氧化物与水反应的化学反应方程式。
7.写出铝、锌、锡与NaOH反应的方程式。
8.分别近似计算下列反应在873K时的![]() 值,并比较Mg、Zn、Mn在该温度时与O2结合能力的强弱。
值,并比较Mg、Zn、Mn在该温度时与O2结合能力的强弱。
① 2Mg+O2=2MgO
② 2Zn+O2=2ZnO
③ 2Mn+O2=2MnO
9.写出Zn与稀H2SO4、Cu与浓HNO3以及Au与王水反应的化学方程式,并指出各反应中起氧化作用的元素。
10.写出反应Fe![]() 的表达式。并分别讨论该系统在什么条件下有利于钢铁的渗碳?什么条件下有利于钢铁的脱碳?
的表达式。并分别讨论该系统在什么条件下有利于钢铁的渗碳?什么条件下有利于钢铁的脱碳?
11.已知铁在
3Fe(s)+2CO(g)=Fe![]() ,在总渗碳室内铁工件处于CO2和CO体积比为80:20的混合气氛中,渗碳室总压力为100kpa,问铁工件是脱碳还是渗碳?
,在总渗碳室内铁工件处于CO2和CO体积比为80:20的混合气氛中,渗碳室总压力为100kpa,问铁工件是脱碳还是渗碳?
12.什么叫硬质合金?硬质合金有哪些重要用途?
13.什么是纳米材料?纳米材料有哪些主要特性?
第九章 习题
1.是非题
(1)主族元素单质的熔点变化规律是在周期表的中间较高,两边较低 ( )
(2)A1和C12分别是较活泼金属和活泼非金属,因此A
(3)非金属的氧化物都是分子晶体,熔点较低。 ( )
(4)三氯化铋溶于水时产生白色沉淀 ( )
(5)向泡花碱中通入二氧化碳,有胶状物质生成 ( )
(6)石膏的主要成分是碳酸钙。 ( )
(7)光导纤维的主要成分是二氧化硅。 ( )
(8)盛烧碱溶液的瓶赛不能用玻璃塞。 ( )
(9)水泥与水作用生成大量的无定形硅胶,因此水泥石具有较高的强度 ( )
(10)半导体材料不能用作功能转换材料。 ( )
2.填空题
(1)用水玻璃与砂造型时,常加入少量硅粉,其目的是利用硅与 反应产生 。从而加速铸型的硬化。
(2)普通水泥和普通玻璃在化学组成上的共同点是 。
(3) 和 是耐热高强无机材料。
(4) 和 是半导体的两种载流子。
(5) 和 是较常用的半导体元素。
(6) 和 是两性氧化物。
(7) 是酸性耐火材料的主要组分;含较多A12O3的耐火材料是 性的耐火材料。
(8)n型半导体和p型半导体属于 半导体。
(9)SiO2、KI、FeCl3、FeCl2中熔点最高的是 。
(10)SiC、CO2、BaO晶体中硬度最大的是 。
3.选择题
(1)下列制品中不含硅的是( )
(A)唐三彩 (B)秦兵俑 (C)琉璃瓦 (D)石膏像
(2)硅胶可用作( )。
(A)催化剂 (B)吸附剂 (C)黏合剂 (D)防腐剂
(3)光导纤维主要应用的是材料的( )
(A)化学性质 (B)光学性质 (C)电学性质 (D)力学性质
(4)下列组内物质能够共存的是( )
(A)Sn(OH)2和NH4Cl
(B)Na2SiO3和NH
(C)Mg(OH)2和NaOH (D)ZnO和NaOH
(5)下列无机酸中对玻璃有腐蚀作用的是( )
(A)盐酸 (B)氢氟酸 (C)高氯酸 (D)硝酸
(6)在配制BiC13溶液时,为了防止产生白色沉淀,应采取的措施是( )。
(A)加酸 (B)多加水 (C)加热 (D)加碱
(7)下列物质中熔点最高的是( )
(A)SnC14 (B)SiC (C)KC1
(D)A
(8)下列物质中酸性最弱的是( )
(A)H4PO4 (B)HC1O4 (C)H3AsO4 (D)H3AsO3
(9)下列物质中热稳定性最好的是( )
(A)Mg(HCO3)2 (B)H2CO3 (C)MgCO3 (D)BaCO3
(10)能与碳酸钠溶液作用生成沉淀,而此沉淀又能溶于氢氧化钠溶液的是( )
(A)AgNO3 (B)CaC12 (C)Ba(NO3)2 (D)A
4.将下列化合物按熔点上升的顺序排列,并说明理由。
MgO,P2O3,NO2,CrO3,Cr2O3
5.指出下列物质溶于水后,溶液显酸性还是显碱性或显中性。
A
6.指出下列物质哪些是正常氧化物,哪些是过氧化物或超氧化物。
PbO2,SrO2,CrO3,Na2O2,MnO2,SiO2,KO2
7.写出下列氯化物与水反应的方程式
MgC12,ZnCl2,FeCl3,SnCl4,GeCl4,
8.比较下列各组物质酸碱性的强弱。
(1)H3PO4 HC1O4 H2SO4
(2)HClO HBrO HIO
(3)HClO HClO2 HClO3 HClO4
9.试估算在标准条件下BaCO3的热分解温度。已知热分解反应BaCO3(s)=BaO(s)+CO2(g)![]() ,
, ![]() 。
。
10.精细陶瓷与传统陶瓷在哪些方面不同?
参考答案
第七章
8.(1)![]() ,正反应自发进行。
,正反应自发进行。
(2)![]() ,正反应不能自发进行。
,正反应不能自发进行。
10.(1)![]() ;
;
(2)E=0.211V
11.E=﹣0.3247V,正反应不能自发进行。
12.![]() 。
。
13.![]() 。
。
15.(1)![]() ;
;
(2)![]() (向右进行);
(向右进行);
(4)E=1.7V。
17.(1)![]() ;
;
(2)![]() 。
。
反应(2)比反应(1)进行得更完全。
第八章
8.(1)![]() =-1014
=-1014![]()
(2)![]() =-522
=-522![]()
(3)![]() =-639
=-639![]()
与O2结合能力Mg>Mn>Zn
11.J=20<![]() ,铁工件是渗碳。
,铁工件是渗碳。