考试科目:无机化学 (1) 共 7 页
课程编码: 210401 考试时间:
专业班级: 学号: 学生姓名:
总成绩 |
|
总分人 |
|
核查人 |
|
题 号 |
成 绩 |
阅卷人 |
核查人 |
一 |
|
|
|
二 |
|
三 |
|
|
|
四 |
|
五 |
|
|
|
六 |
|
|
|
|
|
|
|
一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×) (本大题分10小题,每小题1分,共10分)
1、原电池-)Cu|Cu2+(0.01mol·L-1)┊┊Cu2+(0.10mol·L-1)︱Cu(+)的电池反应为:Cu2+(0.10mol·L-1)=Cu2+(0.01mol·L-1)………………………………………()
2、在实验室中MnO2(s)仅与浓HCl加热才能反应制取氯气,这是因为浓HCl仅使E(MnO2/Mn2+)增大。…………()
3、在恒温恒压下,某化学反应的热效应Qp=△H=H2-H1,因为H是状态函数,故Qp也是状态函数。....()
4、在Na3PO4溶液中,c(Na+)恰是c(PO43-)的3倍。...............................()
5、因为△rG(T)=-RTlnK,所以温度升高,K减小。................()
6、化学反应3A(aq)+B(aq)→2C(aq),当其速率方程式中各物质浓度均为1.0mol·L-1时,其反应速率系数在数值上等于其反应速率。.........................()
7、配合物[CrCl2(H2O)4]Cl应命名为一氯化四水·二氯合铬(Ⅲ)……………………….()
8、根据酸碱质子理论,对于反应HCN+H2OH3O++CN-来说,HCN和H3O+都是酸()
9、根据同离子效应,沉淀剂加入越多,其离子沉淀越完全。…………..…()
10、配合物形成体的配位数是指直接和中心原子或(离子)相连的配体总数。………()) 二、选择题(在下列各题中,选择出符合题意的答案将其代号填入括号内)(本大题分15小题,每小题2分,共30分)
1、分压定律适用于真实气体混合物的条件,除在所处的温度区间内气体间不发生化学反应外,这些气体所处的状态是…()。
(A)高温,低压;(B)高温,高压;(C)低温,低压;(D)低温,高压。
2、下列反应中,反应的标准摩尔焓变与相应生成物的标准摩尔生成焓相等的是...........()。
(A)CO2(g)+CaO(s)→CaCO3(s);(B)H2(g)+I2(g)→HI(g);
(C)H2(g)+I2(g)→2HI(g);(D)H2(g)+O2(g)→H2O(g)。
3、某反应3A(s)+2B(g)→A3B2(s),在低温时为自发的,其逆反应在高温时自发进行,由此可知该反应...................................…...........()。
(A)△rHm<0,△rSm<0;(B)△rHm<0,△rSm>0;
(C)△rHm>0,△rSm<0;(D)△rHm>0,△rSm>0。
4、已知某化学反应是吸热反应,如果升高温度,则对反应的反应速率系数k和标准平衡常数K的影响将是.....................()。
(A)k增加,K减小;(B)k、K均增加;
(C)k减小,K增加;(D)k、K均减小。 5、催化剂的作用是通过改变反应进行的历程来加快反应速率,这一作用主要是由于.....()。
(A)降低反应活化能;(B)减小速率系数值;
(C)增大平衡常数;(D)增大碰撞频率。
6、密闭容器中,A、B、C三种气体建立了化学平衡,有关反应是:A(g)+2B(g)C(g)。相同温度下体积增大一倍,则标准平衡常数K为原来的…………()。
(A)4倍;(B)2倍;(C)3倍;(D)1倍。
7、下列各物质加到1L水中,能配制成缓冲溶液的是..........()。
(A)1molH2SO4和1molHCl;(B)1molNaOH和1molKOH;
(C)1molNaOH和1molHCl;(D)1molHAc和0.5molNaOH。
8、根据酸碱电子理论,下列物质中,可作为Lewis碱的是.()。
(A)Fe3+;(B)Cu2+;(C)F-;(D)SO3。
9、下列沉淀中,可溶于1mol·L-1NH4Cl溶液中的是.............…()。
(A)Fe(OH)3(K=4′10-36);(B)Mg(OH)2(K=1.8′10-11);
(C)Al(OH)3(K=1.3′10-33);(D)Cr(OH)3(K=6.3′10-31)。
10、在HAc溶液中,加入适量NH4Ac来抑制HAc的解离,这种作用为…………()。
(A)缓冲作用;(B)同离子效应;(C)盐效应;(D)稀释作用。
11、有体积相同的K2CO3溶液和(NH4)2CO3溶液,其浓度分别为amol·L-1和bmol·L-1。现测得两种溶液中所含CO32-的浓度相等,a与b相比较,其结果是…()。
(A)a=b;(B)a>b;(C)a<b;(D)a>>b。
12、根据酸碱质子理论,下列物质中不可以作为碱的是...()。
(A)H2O;(B)NH3;(C)HSO4-;(D)NH4+。
13、已知在1123K时,反应C(s)+CO2(g)2CO(g)K=1.3×1014
CO(g)+Cl2(g)COCl2(g)K=6.0×10-3则反应
2COCl2(g)C(s)+CO2(g)+2Cl2(g)的K=.............................()。
(A)4.8×109;(B)2.1×10-10;(C)3.6×10-5;(D)1.3×10-12。
14、在298K时,反应:HCl(g)+NH3(g)→NH4Cl(s)的△rH=-176.0kJ·mol-1,△rS=-284.5J·mol-1·K-1,则该反应的lgK=................................()。
(A)1.60×10-2;(B)-15.987;(C)30.860;(D)15.987
15、欲使CaCO3在水溶液中的溶解度增大,宜采用的方法是()。
(A)加入1.0mol·L-1Na2CO3;(B)加入2.0mol·L-1NaOH;
(C)加入1.0mol·L-1CaCl2;(D)加入0.1mol·L-1edta。
三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值)(本大题分5小题,每小题2分,共10分)
1、在溶液中,存在下列平衡:[CoF6]3-Co3++6F-,当加入硝酸时,上述平衡将向_______移动,这是由于生成_________使__________浓度________的结果。
2、配离子[Cd(CN)4]2-的配位体是_________;配位原子是_______;配位数是_______;命名为______________________________________________。
3、已知K([Zn(OH)4]2-)>K([Zn(NH3)4]2+)。则反应:
[Zn(NH3)4]2++4OH-[Zn(OH)4]2-+4NH3的标准平衡常数K与这两种配离子的K之间的关系式为K=____________,在标准状态下,反应将向______进行。
4、在标准状态时,反应2Fe3++2I-I2(s)+2Fe2+向右进行,这表明E(Fe3+/Fe2+)比E(I2/I-)______。当Fe3+、Fe2+均形成CN-配合物时,反应2[Fe(CN)6]4-+I22[Fe(CN)6]3-+2I-在标准状态时向右进行,这表明E([Fe(CN)6]3-/[Fe(CN)6]4-)_______E(I2/I-)。
5、已知反应:CO(g)+2H2(g)CH3OH(g),其523K时K=2.33×10-3;548K时K=5.42×10-4。该反应是__________热反应,当温度升高时,平衡向__________方向移动。系统加压,平衡向__________方向移动;加入催化剂,平衡__________。
四、配平题(配平下列各反应方程式)(本大题分5小题,每小题2分,共10分)
1、N2H4+H2O2HNO3+H2O
2、ClO3-+Al+OH-Al(OH)4-+Cl-
3、As2O3+Ag2O+OH-AsO43-+Ag
4、H2S+HNO3(浓)NO2+S
5、 S2O42- + I2 + OH-  SO42- + I- SO42- + I-
五、问答题(本大题共3小题,总计16分)
1、(本小题6分)
试用活化分子概念解释反应物浓度、温度、催化剂对化学反应速率的影响。 2、(本小题5分)
已知下列沉淀转化反应均能自发正向进行( K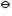 > 1 ): > 1 ):
PbCl2 + 2 I- 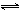 PbI2 + 2 Cl- PbI2 + 2 Cl-
PbI2 + CrO42- 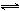 PbCrO4 + 2 I- PbCrO4 + 2 I-
PbCrO42- + S2- 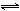 PbS + CrO42- PbS + CrO42-
根据上述事实,试排列 PbCl2 、PbI2 、PbCrO4 、PbS 各难溶物质的K 由大到小的顺序。 并推断出上述各物质间还能发 生多少个沉淀转化反应,以反应方程式表示之。 由大到小的顺序。 并推断出上述各物质间还能发 生多少个沉淀转化反应,以反应方程式表示之。
3、(本小题5分)
已知:O2 + 2H+ + 2e- 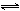 H2O2 ; E H2O2 ; E = 0.682 V = 0.682 V
H2O2 + 2H+ + 2e- 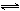 2H2O ; E 2H2O ; E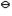 = 1.77 V = 1.77 V
1).画出在酸性介质中氧元素电势图。
2).判断H2O2能否歧化;若能歧化,写出其发生歧化反应的方程式。
六、计算题 (根据题目要求 , 解答下列各题) (本大题共3小题,总计24分)
1、(本小题8分)
K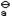 =1.0×10-5)与等体积0.20mol·L-1NaOH溶液混合。试计算混合溶液的c(HA)和pH值。 =1.0×10-5)与等体积0.20mol·L-1NaOH溶液混合。试计算混合溶液的c(HA)和pH值。 2、(本小题8分)
反应:H2PO3-+OH-→HPO32-+H2O,100℃时,反应物浓?度和反应速率关系如下:
c(H2PO3-)/(mol·L-1)c(OH-)/(mol·L-1)r/(mol·L-1·s-1)
0.101.03.2×10-5
0.501.01.6×10-4
0.504.02.56×10-3
(1)写出速率方程表达式;(2)指出反应级数;(3)计算反应速率系数;(4)若H2PO3-、OH-的浓度均为1.0mol·L-1时反应速率为多少 3、(本小题8分)
已知:E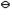 (Ag+/Ag)=0.799V,K (Ag+/Ag)=0.799V,K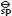 (AgCl)=1.8′10-10。若在半电池AgAg+(1.0mol·L-1)中加入KCl,生成AgCl沉淀后,使得c(KCl)=1.0mol·L-1,则其电极电势将增加或降低多少如果生成AgCl沉淀后,c(Cl-)=0.10mol·L-1则E(Ag+/Ag)、E(AgCl/Ag)各为多少 (AgCl)=1.8′10-10。若在半电池AgAg+(1.0mol·L-1)中加入KCl,生成AgCl沉淀后,使得c(KCl)=1.0mol·L-1,则其电极电势将增加或降低多少如果生成AgCl沉淀后,c(Cl-)=0.10mol·L-1则E(Ag+/Ag)、E(AgCl/Ag)各为多少
答案见附件一
西安建筑科技大学考试试卷(A) 考试科目:无机化学 (2) 共 6 页
课程编码: 210401 考试时间:
专业班级: 学号: 学生姓名:
总成绩 |
|
总分人 |
|
核查人 |
|
题 号 |
成 绩 |
阅卷人 |
核查人 |
一 |
|
|
|
二 |
|
三 |
|
|
|
四 |
|
五 |
|
|
|
六 |
|
|
|
|
|
|
|
一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×)(本大题分10小题,每小题1分,共10分)
1、3d能级对应的量子数为n=3,l=3。...................................................()
2、内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。..............()
3、Cu(Ⅰ)的配合物易发生歧化反应,它们在水溶液中不能稳定存在。…………...()
4、Hg2+的氧化性强于Hg22+。………....................................................()
5、由于生成难溶盐,Ag(Ⅰ)的氧化性减弱。........................................()
6、高碘酸有强氧化性,必须在碱性条件下,氯气才能将碘酸盐氧化为高碘酸盐。...........()
7、分子晶体的特性之一是熔点均相对较低。....................................................()
8、AgNO3试液应存放于棕色瓶中。......................................................()
9、第二周期中N的第一电离能比它前后相邻的C和O都要大。......................()
10、NCl3和PO43-的中心原子均采用等性sp3杂化。......................................()
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)
(本大题分15小题,每小题2分,共30分)
1、氢原子的原子轨道能量取决于量子数..............................................()。
(A)n;(B)n和l;(C)l;(D)m。
2、下列分子中存在p键的是..................................................................()。
(A)PCl3;(B)HCl;(C)H2;(D)N2。
3、配合物的磁矩主要取决于形成体的.............................................()。
(A)原子序数;(B)电荷数;(C)单电子数;(D)成对电子数。
4、在其原子具有下列外层电子构型的各元素中,电负性最大的是.........()。
(A)ns2;(B)ns2np3;(C)(n-1)d3ns2;(D)ns2np5。
5、下列有关原子晶体的叙述中正确的是...................................................()。
(A)原子晶体只能是单质;
(B)原子晶体中存在单个分子;
(C)原子晶体中原子之间以共价键相结合;
(D)原子晶体中不存在杂化的原子轨道。
6、下列物质见光不分解的是..........()。
(A)Hg2I2;(B)HgI2;(C)AgI;(D)KMnO4。
7、下列离子中,能与适量NaOH溶液反应生成沉淀,而NaOH溶液过量时沉淀消失的是…()。
(A)Co2+;(B)Zn2+;(C)Ag+;(D)Ni2+。
8、ABm型分子中,m=6,中心原子采取sp3d2杂化方式,则分子的空间几何构型是...............................()。
(A)平面正方形;(B)四方锥;
(C)T形;(D)八面体。
9、下列分子中不呈直线形的是..............................................()。
(A)HgCl2;(B)CO2;(C)H2O;(D)CS2。
10、下列物质中熔点最高的是.................................................()。
(A)SiO2;(B)SO2;(C)NaCl;(D)SiCl4。
11、若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了........()。
(A)能量守恒原理;(B)Pauli(泡利)不相容原理;
(C)能量最低原理;(D)Hund(洪德)规则。
12、价键理论认为,决定配合物空间构型主要是.......................()。
(A)配体对中心离子的影响与作用;
(B)中心离子对配体的影响与作用;
(C)中心离子(或原子)的原子轨道杂化方式;
(D)配体中配位原子对中心原子的作用。
13、下列离子在水溶液中不发生歧化反应的是.........()。
(A)Cu+;(B)MnO42-;(C)Fe2+;(D)Mn3+。
14、下列物质中不能作为配合物的配体的是............()。
(A)NH3;(B)NH4+;(C)CH3NH2;(D)C2H4(NH2)2。
15、对下图所示,正确的叙述是...........................()。
(A)图形表示py原子轨道的形状;
(B)图形表示py原子轨道角度分布图;
(C)图形表示py电子云角度分布图;
(D)图形表示px原子轨道的形状。 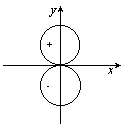
三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值)(本大题分5小题,每小题2分,共10分)
1、CuSO4溶液与过量的6mol·L-1NaOH溶液反应生成______色的________,再加入葡萄糖溶液并加热,会生成_______色的____________。
2、在Hg2(NO3)2溶液中加入少量的KI溶液,生成_______色的__________,继续加入过量的KI溶液,则生成___________和____________。
3、预测BeCl2的熔点比MgCl2的熔点________,这是因为Be2+的离子半径比Mg2+的离子半径________,Be2+的极化力比Mg2+的________,从而使BeCl2晶型向________转化更为显著所致。
4、在HgCl2溶液中加入氨水生成________色的__________沉淀,再加入过量的氨水和NH4Cl,则生成_______色的______________。
5、已知BeO的熔点比LiF的熔点高,这是因为离子电荷Be2+比Li+高,离子半径r(Be2+)比r(Li+)________,使BeO的晶格能必然比LiF的________,所以BeO的熔点高于LiF。
四、配平题(完成并配平下列各反应方程式)(本大题分5小题,每小题2分,共10分)
1、二氧化铅与盐酸反应。 2、 Na2O2(s)+MnO4-+H+→ 3、 CoBr2+O2+KOH+H2O→Co(OH)3 4、少量的氯化亚锡与氯化汞溶液反应。 5、 Na+O2(空气)
五、根据题目要求,解答下列各题 (本大题共4小题,总计40分) 1、(本小题10分)
按照分子轨道理论,原子轨道组合成分子轨道后,电子在分子轨道中的排布要遵循哪些原则 以O2分子为例,怎样用分子轨道理论说明其具有顺磁性
2、(本小题8分)
取向力只存在于极性分子之间。色散力只存在于非极性分子之间。这两句话是否正确 试解释之。
3、(本小题10分)
如何区分AgCl和HgCl2 设计两种方法,加以简要说明。写出相应的反应方程式。 4、(本小题12分)
解释下列事实:
(1)不能用硝酸与FeS作用制备H2S;
(2)亚硫酸是良好的还原剂,浓硫酸是相当强的氧化剂,但两者相遇并不发生反应;
(3)将亚硫酸盐溶液久置于空气中,将几乎失去还原性。
答案见附件一 |